- 1. Identifica los diferentes periodos históricos en el desarrollo de la Química como Ciencia hasta la actualidad
- 2. Reconoce la importancia del método científico en la Química como Ciencia y en otras áreas del conocimiento humano
- 3. Comprende la diferencia entre sustancias puras y mezclas, y a su vez, entre mezclas homogéneas y mezclas heterogéneas.
- 4. Establece la diferencia entre los cambios físicos y químicos en la materia.
- 5. Define a partir de su interpretación personal los conceptos de propiedad física y propiedad química.
- 6. Comprende la diferencia entre cambios físicos y cambios químicos.
- 7. Interpreta la importancia de las unidades de medición en la historia de la humanidad y de la Ciencia en forma específica.
- 8. Identifica las diferentes etapas en la historia del desarrollo de la teoría atómica moderna.
- Guía de actividades
- Actividad 1
- Actividad 2
- Actividad 3
- Actividad 4
- Actividad 5
- Actividad 6
- Fuentes de aprendizaje
Guía de actividades
Desarrolla las Actividades de la Guía 1 Nivel 1 de Desempeño. El formato de entrega de las actividades es en Microsoft Office Word, excepto para aquellos puntos donde se te solicita realizarlos en Microsoft Office PowerPoint u otro programa.
Recuerda que antes de resolver las actividades, debes descargar y estudiar la «Guía de Aprendizaje» que se encuentra en el «Menú: Contexto de la Guía en formato Word». En el mismo «Menú: Contexto de la Guía», también encuentras algunas lecciones referentes a los temas tratados. Es importante que consultes las Fuentes de Aprendizaje dispuestas para el presente Nivel de Desempeño.
Descarga las Actividades de la Guía 1 Nivel 1 de Desempeño, que se encuentran en el documento en formato Word al lado derecho debajo de la barra de Menú.
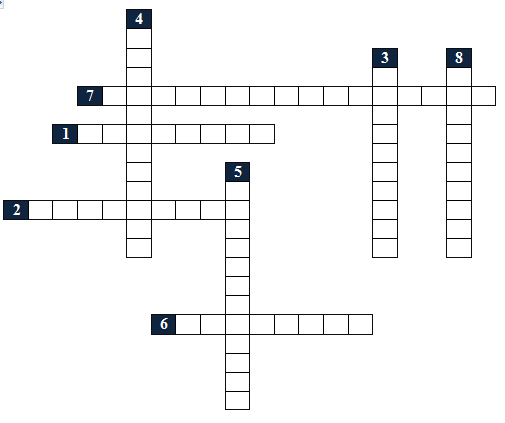
Actividad No. 1: Historia de la Química
| |
|
|
| |
|
Descripción de la actividad |
|
PALABRAS DEL CRUCIGRAMA |
1 |
Periodo que se centró en la búsqueda de la piedra filosofal y en la obtención del elixir de la vida. |
2 |
Apellido del científico que explicó la combustión como un proceso de oxidación, dando fin al Periodo del Flogisto, y descubrió La Ley de la Composición Definida. |
3 |
Personaje que afirmó lo siguiente: «Propongo que el Universo solo puede estar constituido por: Tierra, Aire, Fuego y Agua; con las propiedades: frío, húmedo, caliente y seco.» |
4 |
En este Periodo existió Paracelso, quien consideró que se podían producir drogas para tratar enfermedades mediante la Química. |
5 |
La Química como tal no existía, solo existían procedimientos rutinarios como preparar pigmentos, esencias de olores, y técnicas de embalsamiento. |
6 |
Lo que podemos considerar el “antioxígeno” en la actualidad, como la interpretación a lo que quería significar Sthal en su época. |
7 |
Son todos los cambios que se presentan en la naturaleza y en los seres vivos. |
8 |
Fue quien inició la principal evolución de la Química durante el siglo XIX con su teoría atómica. |
|
|
|
|
| |
|
|
Actividad No. 2: El método científico
| |
|
|
| |
|
Descripción de la actividad |
|
Realiza la siguiente lectura tomada del texto «100 Preguntas Básicas sobre la Ciencia de Isaac Asimov»:
- «¿Qué es el método científico?
Evidentemente, el método científico es el método que utilizan los científicos para hacer descubrimientos científicos. Pero esta definición no parece muy útil. ¿Podemos dar más detalles?
Pues bien, cabría dar la siguiente versión ideal de dicho método:
- Detectar la existencia de un problema, como puede ser, por ejemplo, la cuestión de por qué los objetos se mueven como lo hacen, acelerando en ciertas condiciones y decelerando en otras.
- Separar luego y desechar los aspectos no esenciales del problema. El olor de un objeto, por ejemplo, no juega ningún papel en su movimiento.
- Reunir todos los datos posibles que incidan en el problema. En los tiempos antiguos y medievales equivalía simplemente a la observación sagaz de la naturaleza, tal como existía. A principios de los tiempos modernos empezó a entreverse la posibilidad de ayudar a la naturaleza en ese sentido. Cabía planear deliberadamente una situación en la cual los objetos se comportaran de una manera determinada y suministraran datos relevantes para el problema. Uno podía, por ejemplo, hacer rodar una serie de esferas a lo largo de un plano inclinado, variando el tamaño de las esferas, la naturaleza de su superficie, la inclinación del plano, etc. Tales situaciones deliberadamente planeadas son experimentos, y el papel del experimento es tan capital para la ciencia moderna, que a veces se habla de "ciencia experimental" para distinguirla de la ciencia de los antiguos griegos.
- Reunidos todos los datos elabórese una generalización provisional que los describa a todos ellos de la manera más simple posible: un enunciado breve o una relación matemática. Esto es una hipótesis.
- Con la hipótesis en la mano se pueden predecir los resultados de experimentos que no se nos habían ocurrido hasta entonces. Intentar hacerlos y mirar si la hipótesis es válida.
- Si los experimentos funcionan tal como se esperaba, la hipótesis sale reforzada y puede adquirir el status de una teoría o incluso de un "ley natural".
Está claro que ninguna teoría ni ley natural tiene carácter definitivo. El proceso se repite una y otra vez. Continuamente se hacen y obtienen nuevos datos, nuevas observaciones, nuevos experimentos. Las viejas leyes naturales se ven constantemente superadas por otras más generales que explican todo cuanto explicaban las antiguas y un poco más.
Todo esto, como digo, es una versión ideal del método científico. En la práctica no es necesario que el científico pase por los distintos puntos como si fuese una serie de ejercicios caligráficos, y normalmente no lo hace.
Más que nada son factores como la intuición, la sagacidad y la suerte, a secas, los que juegan un papel. La historia de la ciencia está llena de casos en los que un científico da de pronto con una idea brillante basada en datos insuficientes y en poca o ninguna experimentación, llegando así a una verdad útil cuyo descubrimiento quizá hubiese requerido años mediante la aplicación directa y estricta del método científico.
F. A. Kekulé dio con la estructura del benceno mientras descabezaba un sueño en el autobús. Otto Loewi despertó en medio de la noche con la solución del problema de la conducción sináptica. Donald Glaser concibió la idea de la cámara de burbujas mientras miraba ociosamente su vaso de cerveza.
¿Quiere decir esto que, a fin de cuentas, todo es cuestión de suerte y no de cabeza? No, no y mil veces no. Esta clase de "suerte" sólo se da en los mejores cerebros; sólo en aquellos cuya "intuición" es la recompensa de una larga experiencia, una comprensión profunda y un pensamiento disciplinado.»
Con base en una comprensión e interpretación específica del texto anterior, de acuerdo con las ideas propuestas por el autor, responde las siguientes preguntas argumentando tu respuesta:
- ¿Si queremos resolver todo tipo de problemas que se le plantean a la humanidad, entonces siempre debemos aplicar el método científico, porque de lo contrario nunca encontraremos la solución a los problemas que se presenten?
- Aunque los científicos apliquen con rigurosidad el método científico a su labor investigativa, ¿puede ser cuestión de «suerte» que cualquier científico llegue a un descubrimiento importante?
- Responda si está o no de acuerdo con la siguiente afirmación sustentando su respuesta: Los pasos del método científico establecidos en la Guía de Aprendizaje No. 1(sección 1.2. El método científico, páginas 6 a 8), son los únicos válidos que han sido establecidos por la Ciencia a nivel mundial, por tanto, las objeciones de Isaac Asimov son totalmente erróneas.
- Establezca un cuadro de comparación (diferencias y similitudes) entre los pasos del método científico establecidos en la Guía de Aprendizaje No. 1(sección 1.2. El método científico, páginas 6 a 8), y los pasos propuestos por Isaac Asimov en la lectura anterior, completando el siguiente cuadro:
Pasos del Método Científico
(Guía 1 Grado Décimo) |
Pasos del Método Científico
(Isaac Asimov) |
1 |
Observación |
1 |
Periodo que se centró en la búsqueda de la piedra filosofal y en la obtención del elixir de la vida. |
2 |
Formulación de preguntas |
2 |
Separar y desechar aspectos no esenciales del problema. |
3 |
Formulación de hipótesis |
3 |
Reunir todos los datos posibles que incidan en el problema. |
4 |
Datos experimentales |
4 |
Elaborar una hipótesis que generalice los datos reunidos. |
5 |
Organización de la información |
5 |
Predecir resultados de otros experimentos. |
6 |
Análisis de resultados y conclusiones |
6 |
Formulación de teorías o de leyes naturales. |
|
|
|
|
| |
|
|
Actividad No. 3: Clasificación de la Materia
| |
|
|
| |
|
Descripción de la Actividad |
|
Realiza la siguiente lectura tomada del texto «Química General» de Ralph H. Petrucci:
«Elementos y compuestos son sustancias puras: su composición y sus propiedades son uniformes en toda la extensión de una muestra dada. También existen muchas combinaciones de elementos y/o compuestos que tienen una composición uniforme y propiedades constantes, pero que no son consideradas como sustancias puras, éstas son mezclas homogéneas o soluciones. Una mezcla homogénea puede ser separada en dos o más constituyentes por medio de cambios físicos apropiados. El aire ordinario y el agua de mar son dos ejemplos comunes de mezclas homogéneas.
Los componentes de algunas mezclas están segregados en regiones físicamente discernibles, de lo que resulta que la composición y sus propiedades físicas varían de una parte de la mezcla a otra. De esta mezcla se dice que es una mezcla heterogénea. Muestras de materia que abarcan desde un vaso de té con hielo, un vaso de leche con cereales o una veta de oro y diamantes.»
De acuerdo con la comprensión y análisis de la lectura anterior, y el estudio de la Guía 1 Grado Décimo [1], deduzca la(s) afirmación(es) verdadera(s) y falsa(s). Justifique su respuesta:
- Las mezclas homogéneas no se pueden separadas por métodos físicos de separación, porque la naturaleza química de los compuestos cambia al formar una sola fase.
- Las mezclas homogéneas se puede separadas por métodos físicos de separación, porque la naturaleza química de los compuestos no cambia aunque forman una sola fase.
- Las mezclas heterogéneas se puede separar por métodos físicos de separación, porque la naturaleza química de los compuestos no cambia al formar dos fases separadas.
- Las mezclas heterogéneas no se pueden separar por métodos físicos de separación, porque la naturaleza química de los compuestos cambia y por ello se forman dos fases separadas.
- Respuestas:
- Afirmaciones verdaderas: ____________________
- Afirmaciones falsas: ________________________
- Justificación: _________________________________________________________________________________________
De acuerdo con la comprensión y análisis de la lectura anterior, y el estudio de la Guía 1 Grado Décimo [1], identifique si las muestras de materia descritas a continuación son sustancias puras o mezclas y, si son mezclas, indique si son homogéneas o heterogéneas (justifique su respuesta):
- Un cubo de azúcar
- Un cubo de azúcar disuelto en agua
- Una sopa de legumbres
- Un litro de gasolina
- Medio litro de leche entera
- Una libra de sal yodada
- Un galón de agua
|
|
|
|
| |
|
|
Actividad No. 4: Propiedades de las Sustancias
| |
|
|
| |
|
Descripción de la Actividad |
|
Realiza la siguiente lectura tomada del texto «Química General» de Ralph H. Petrucci:
«Las propiedades de la materia pueden agruparse en dos categorías: las físicas y las químicas.
Color, lustre y dureza son sólo unas pocas de las numerosas propiedades físicas que pueden emplearse, para describir el aspecto de un objeto. Un proceso por medio del cual un objeto cambia su aspecto físico se denomina cambio físico, y el objeto exhibe propiedades físicas al sufrir tal cambio. Un cubo de cobre metálico puede ser aplastado hasta lograr una hoja extremadamente delgada: el cobre es maleable. También se le puede estirar hasta transformarlo en un hilo fino: es dúctil.
El papel arde, el hierro se oxida y la madera se pudre. En cada uno de estos procesos, el objeto involucrado no solamente cambia su apariencia, sino también su identidad básica. La muestra original de materia se combina con otra de su ambiente, para formar materiales completamente diferentes. Los cambios químicos y la capacidad de los materiales para sufrir tales cambios se denominan propiedades químicas.»
De acuerdo con la comprensión y análisis de la lectura anterior, y el estudio de la Guía 1 Grado Décimo [1], defina brevemente y con sus propias palabras las diferencias existentes entre las propiedades físicas y las propiedades químicas.
Señale con una X en el cuadro siguiente, si la propiedad es física o química:
| PROPIEDAD |
FÍSICA |
QUÍMICA |
Densidad |
|
|
Viscosidad |
|
|
Temperatura de ebullición |
|
|
Oxidación |
|
|
Temperatura de fusión |
|
|
Combustión |
|
|
Conductividad eléctrica |
|
|
Biodegradación |
|
|
Solución |
|
|
De acuerdo con la comprensión y análisis de la lectura anterior, y el estudio de la Guía 1 Grado Décimo [1], identifique las propiedades que se miden en los siguientes fenómenos y describa si son químicas o físicas:
- Un clavo de hierro es atraído por un imán, pero una moneda de cobre no.
- Una cuchara de plata se humedece al exponerse al aire, un anillo de oro no.
- El hielo flota en el agua líquida.
- Los objetos de caucho se deshacen en un ambiente con smog.
- Un letrero de neón emite una luz roja-naranja.
De acuerdo con la comprensión y análisis de la lectura anterior, y el estudio de la Guía 1 Grado Décimo [1], identifique y seleccione las afirmaciones verdaderas y falsas de acuerdo con las siguientes afirmaciones:
- Un cambio físico implica necesariamente un cambio en el aspecto físico del objeto.
- Un cambio físico no implica necesariamente un cambio en el aspecto físico del objeto.
- Un cambio químico puede implicar un cambio en el aspecto físico del objeto.
- Un cambio químico solo puede generar un cambio en la naturaleza del objeto.
- Respuestas:
- Afirmaciones verdaderas: ____________________
- Afirmaciones falsas: ________________________
- Justificación: _________________________________________________________________________________________
|
|
|
|
| |
|
|
Actividad No. 5: Magnitudes, Unidades y Medidas
| |
|
|
| |
|
Descripción de la actividad |
|
Realiza una lectura comprensiva del siguiente texto y sintetiza las principales ideas acerca de la historia de las unidades de medición mediante una presentación en Power Point, de mínimo 10 y máximo 15 diapositivas.
Historia de las unidades de medida
«Desde la antigüedad, se han elegido las unidades de medida de forma arbitraria. Varias de estas unidades han sido derivadas de eventos naturales y se ha tratado de que sea de fácil manejo y comprensión. Así, los cuerpos celestes proporcionaron una manera sencilla de calcular el tiempo: el día era el tiempo que transcurría de amanecer a amanecer; el mes, era el tiempo que transcurría entre una cierta fase de la luna y su recurrencia; el año, el tiempo que toma el sol pasar a través de sucesivos cambios de una posición en el ciclo a la misma posición. Las distancias cortas eran medidas por el número de pasos que tomaba cubrir la distancia y las distancias largas eran medidas por el número de días de travesía. Tazones y tazas eran utilizados para medir la capacidad de recipientes. Granos de trigo y cebada eran utilizados para medir peso de objetos de valor. Por miles de años, el trueque fue el medio de cambio, y así no fue necesario usar unidades de monedas. Ahora bien, mientras el hombre vivía en comunidades aisladas, casi no existía comercio ni industrias y por tanto no era tan necesario establecer unidades de medida. Sin embargo, cundo el hombre comenzó a trabajar en grupos, se incrementó el comercio entre ellos y esto indujo el establecimiento de unidades de medida que tuvieran el mismo significado para diversas comunidades. Al principio se establecían unidades para regiones de un mismo país; luego para un país entero y por último, para grupos de países. Se piensa que los romanos fueron los primeros en establecer unidades de medidas ampliamente aceptables. Sin embargo, con la caída del Imperio Romano, estas unidades fueron desechadas. Es importante destacar que el sistema métrico establecido a finales del siglo XVIII, en Francia, es utilizado casi mundialmente en ciencias e ingeniería; solo en algunos países de habla inglesa no lo utilizan para comercio.
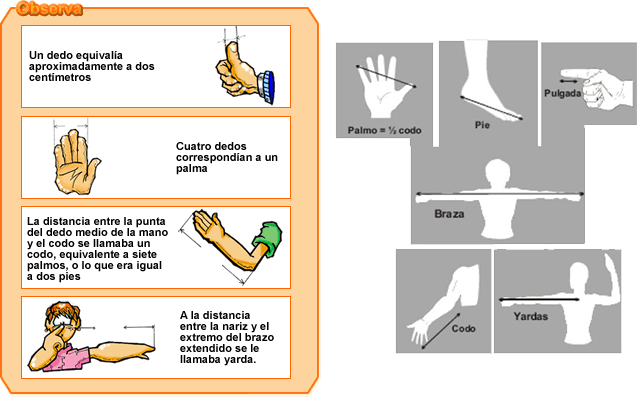
A continuación, se presentan algunas unidades de medida y la costumbre de utilizar el cuerpo humano como base para elegirlas:
- Una de las primeras unidades de medidas de longitud fue el cubito, que fue definido como la longitud del antebrazo desde el codo hasta el extremo del dedo medio. El cubito fue utilizado por los babilonios y los egipcios, aproximadamente 2600 años antes de Cristo. El Arca de Noé, según la Biblia, fue construido con las siguientes dimensiones: 300 cubitos de longitud, 50 cubitos de ancho y 30 cubitos de alto.
- Otra unidad de medida, el pie, fue utilizado por los griegos y romanos. Fue definido como 2/3 de un cubito y llega a Inglaterra al ser ésta conquistada por los romanos.
- El pie fue subdividido por los griegos en doce partes; cada parte al ancho de la uña del pulgar. Cada parte fue llamada por los romanos unicae y mas tarde llamada por los anglosajones pulgadas. Ya que los hombres no tienen el dedo pulgar de igual ancho, el rey Eduardo II, en el siglo XIV, define la pulgada como la longitud de tres granos de maíz tomados del centro de una mazorca.
- Otra unidad de medida, la yarda, fue creada por los comerciantes de ropa ingleses. Al principio fue definida como la distancia del centro del pecho al extremo de los dedos de un brazo extendido (mitad de una “brazada”). El rey Enrique I, quien gobernó a Inglaterra en 1100, define la yarda legal como la distancia del extremo de su nariz al extremo del dedo pulgar de su brazo extendido.
- Para medir pesos, los babilonios usaban piedras seleccionadas y conservadas para ese propósito. Los egipcios y los griegos usaban semillas de trigo como la menor unidad de peso. La uniformidad de peso de las semillas de trigo hizo de este grano una buena unidad de medida. Esto induce a que más tarde se definiera la libra como 7.000 granos de trigo.
Los ejemplos anteriores nos ayudan a ver como las unidades de medidas son originadas en forma arbitraria. Pero, es bueno aclarar que muchas de esas unidades de medida son utilizadas hoy día, a pesar de que ellas han sido reemplazadas por unidades de medidas más precisas. De allí, entonces la importancia de dichas unidades de medidas en las actividades que realiza el hombre en una sociedad.»
Con base en la lectura anterior sobre la Historia de las Unidades de Medida, y de acuerdo con los siguientes gráficos, analiza, compara y deduce las relaciones entre los patrones de medida de la antigüedad y el cuerpo humano. ¿Consideras que deben seguir siendo vigentes estas unidades de medición antiguas o ya han perdido vigencia?
|
|
|
|
| |
|
|
Actividad No. 6: Teoría y Estructura Atómica
| |
|
|
| |
|
Descripción de la actividad |
|
Inferir si las siguientes proposiciones son verdaderas o falsas. Señala con una X entre el paréntesis que aparece al frente de cada proposición, si ésta es Verdadera (V) o Falsa (F):
- (__) Cuando los átomos de un elemento se excitan, generan un espectro característico diferente del de los otros átomos.
- (__) El positrón corresponde a las características de un electrón positivo.
- (__) Los rayos gamma están constituidos por electrones.
- (__) El número máximo de electrones en un nivel es 2n2 y el de subniveles es n.
- (__) Los rayos ultravioleta se producen por la radiactividad.
Asociar las parejas de palabras que se relacionan a continuación. Es decir, colocar entre paréntesis el número al cual corresponden los literales «A» al «H»:
A) H. Becquerel |
( ) |
1. modelo atómico del pudín con pasas |
B) John Dalton |
( ) |
2. modelo atómico basado en la Física Clásica |
C) G.J. Stoney |
( ) |
3. descubrió partículas más pequeñas que el átomo |
D) Böhr |
( ) |
4. uno de los principales atomistas griegos |
E) Rutherford |
( ) |
5. propuso la existencia del electrón |
F) Demócrito |
( ) |
6. comportamiento probabilístico del electrón |
G). E. Schrödinger |
( ) |
7. retomó y reformuló la teoría atómica griega |
H). J.J. Thomson |
( ) |
8. modelo basado en órbitas circulares definidas |
|
|
|
|
| |
|
|
Fuentes de aprendizaje
| |
|
|
| |
|
Fuentes de estudio |
|
Como Fuentes de Aprendizaje en ambientes educativos virtuales, tal y como se define en la metodología de enseñanza-aprendizaje en el I.E. Cibercolegio U.C.N., se permiten las siguientes modalidades para las consultas de información, que se aplican también en la modalidad de estudio presencial y que en la modalidad de estudio virtual se amplían y enriquecen, siempre que se respeten las normas de autor y se citen las fuentes de consulta de forma correcta de acuerdo con las Normas APA v. 8 o la Norma ICONTEC NTC 1486.
Fuentes de aprendizaje virtual: para los estudiantes del Cibercolegio:
- Materiales didácticos, como interactivos, tutoriales, sitios Web o libros electrónicos, entre otras. Es probable que esta información sea más susceptible a ser modificada y actualizada que los medios impresos. En internet, hacemos uso de «buscadores» y «metabuscadores» para consultar información. Además, existen sitios de internet donde se pueden subir y compartir videos educativos.
- Buscadores: Son programas o aplicaciones que al ingresar una palabra en el recuadro nos brindan toda la información recopilada en diferentes páginas anexas. Los buscadores más usados son: Google.com, Yahoo.com; otros buscadores son: Ask.com, Altavista.com, Noxtrum.com, Overture.com, Terra.com y AOL.com, entre otros.
- Metabuscadores: Son servicios que lanzan a internet sus robots (un software) que ordenan y clasifica las páginas que encuentran en internet sirviéndose de criterios objetivos que deberan hallar en el código HTML de esas páginas, los títulos y textos de las mismas. Los metabuscadores no disponen de una base de datos propia que mantener sino que utilizan las de varios buscadores para encontrar la información solicitada por el usuario. Después muestra una combinación de las mejores páginas que ha devuelto cada buscador. Algunos de los metabuscadores más conocidos son: Lomejor.com, Vivisimo.com, Copernic.com, Ixquick.com, Metacrawler.com, Albany.net, Dogpile.com, entre otros.
- Sitios para subir, ver y compartir videos: Se puede decir que el más popular es Youtube.com, sin embargo, existen otros sitios como: Vimeo.com y DailyMotion.com, entre otros.
- Comunicación e interacción a través de herramientas de internet: el correo electrónico, videoconferencias ó llamadas (Skype), enlaces asincrónicos, grupos de discusión (Foros de Plataforma), entre otros, para consultas con el Facilitador o grupos de estudio. Si la modalidad es «asincrónica», la comunicación es predominantemente escrita, a diferencia de la modalidad «sincrónica» en la cual la comunicación oral es predominante.
- Contexto natural, sería enriquecido a través de los sistemas de realidad virtual, simuladores o video entre otros. Con este recurso, los estudiantes pueden realizar un número ilimitado de observaciones o pruebas, mientras que en la modalidad presencial, estas posibilidades son más reducidas.
Como ejemplos de recursos educativos de acuerdo con las Fuentes de Aprendizaje descritas, para complementar y ampliar el estudio de las presentes actividades de la Guía 1 Nivel 1, además la Guía 1 de Aprendizaje y los recursos educativos dispuestos en Plataforma para Grado Décimo, tenemos los siguientes videos de Youtube:
Historia de la química 
Método Científico 
Clasificación de la Materia 
Propiedades de las sustancias 
Magnitudes, unidades y medidas 
Teoría y estructura atómica 
|
|
|
|
| |
|
|
|
|
|
| |
|
| |
| |
| |
|
|
| |
Descargar  Formato word Formato word
Actividad Nivel 1 |
|
|
| |
|
|
|
|
|
|