- Utiliza la tabla periódica para determinar propiedades físicas y químicas de los elementos.
- Establece la relación entre la configuración electrónica de los elementos y su agrupación en la tabla periódica.
- Comprende los conceptos referentes a las propiedades periódicas de los elementos.
- Explica la relación entre la estructura de los átomos y los enlaces que realiza.
- Diferencia los distintos tipos de enlaces químicos y sus propiedades.
- Describe los pasos necesarios para establecer estructuras de Lewis correctas.
- Relaciona grupos funcionales con las propiedades físicas y químicas de las sustancias.
- Identifica las diferentes funciones químicas inorgánicas.
- Describe los sistemas de nomenclatura en química inorgánica.
- Guía de actividades
- Actividad 1
- Actividad 2
- Actividad 3
- Fuentes de actividad
Guía de actividades
Desarrolla las Actividades de la Guía 2, Nivel 1 de Desempeño. El formato de entrega de las actividades es en Microsoft Office Word, excepto para aquellos puntos donde se te solicita realizarlos en otro programa.
Recuerda que antes de resolver las actividades, debes descargar y estudiar la «Guía de Aprendizaje» que se encuentra en el «Menú: Contexto de la Guía en formato Word». En el mismo «Menú: Contexto de la Guía» también encuentras algunas lecciones referentes a los temas tratados. Es importante que consultes las Fuentes de Aprendizaje dispuestas para el presente Nivel de Desempeño.
Descarga las Actividades de la Guía 2 Nivel 1 de Desempeño, que se encuentran en el documento en formato Word al lado derecho debajo de la barra de Menú.
Actividad No. 1: Tabla Periódica
| |
|
|
| |
|
Descripción de la actividad |
La estructura del átomo
-
Verdadero o falso
Identificar cuáles de las siguientes proposiciones son verdaderas o falsas. Señala con una X en el paréntesis que aparece al frente de cada proposición, si ésta es Verdadera (V) o Falsa (F). Luego, sustenta tus respuestas:
| Número |
Elemento |
Proposición |
| 1 |
(Elija un elemento) |
La ley periódica establece que: «las propiedades periódicas son función del número de protones del núcleo». |
| 2 |
(Elija un elemento) |
En un grupo de la Tabla Periódica se sitúan los elementos que presentan todas sus propiedades iguales. |
| 3 |
(Elija un elemento) |
Los elementos que tienen completamente lleno con electrones, el subnivel «p» del último nivel, son gases nobles. |
| 4 |
(Elija un elemento) |
El elemento neutro que cuando gana 2 (dos) electrones queda como un ion isoelectrónico con el gas noble del Periodo 4, se localiza en el Grupo IIA y Periodo 4. |
| 5 |
(Elija un elemento) |
El elemento neutro que pierde un electrón y se convierte en un ion isoelectrónico con el gas noble del Periodo 3, se localiza en el Periodo 4 y Grupo IA. |
| 6 |
(Elija un elemento) |
El átomo de un elemento que se localiza en el Periodo 4 y Grupo IIIA tiene como número atómico 31. |
| 7 |
(Elija un elemento) |
El tamaño atómico disminuye en un Grupo de la Tabla Periódica de abajo hacia arriba. |
| 8 |
(Elija un elemento) |
La energía de ionización disminuye de izquierda a derecha en un Periodo. |
| 9 |
(Elija un elemento) |
La energía de ionización del nitrógeno (Z=7) es mayor que la del oxígeno (Z=8). |
| 10 |
(Elija un elemento) |
Los elementos del grupo IB se llaman metales alcalinotérreos. |
Sustentación: debes explicar por qué una u otra proposición como Verdadera o Falsa:
| Número |
Sustentación |
| 1 |
R/: sustente su respuesta. |
| 2 |
R/: sustente su respuesta. |
| 3 |
R/: sustente su respuesta. |
| 4 |
R/: sustente su respuesta. |
| 5 |
R/: sustente su respuesta. |
| 6 |
R/: sustente su respuesta. |
| 7 |
R/: sustente su respuesta. |
| 8 |
R/: sustente su respuesta. |
| 9 |
R/: sustente su respuesta. |
| 10 |
R/: sustente su respuesta. |
-
Completación
Completar los espacios en blanco en las siguientes frases:
- La energía necesaria para remover un electrón de un átomo se denomina: (elija un elemento).
- Los metales se caracterizan por tener una energía de ionización Elija un elemento. En tanto que, en los no-metales la energía de ionización es: (elija un elemento).
- La energía liberada cuando un átomo neutro en el estado gaseoso forma un anión luego de atraer un electrón es: (elija un elemento).
- A lo largo de un Periodo, el radio atómico aumenta de: (elija un elemento). Mientras que en un Grupo, el radio atómico disminuye de: (elija un elemento).
- La tendencia relativa que posee un átomo para atraer los electrones que hacen parte de un enlace químico es la: (elija un elemento).
- La electronegatividad aumenta en un Grupo de Elija un elemento. Y disminuye en un Periodo de: (elija un elemento).
- Los elementos del Grupo IIA se denominan: (elija un elemento).
- Los elementos metálicos de los grupos IA al VIA se identifican como: (elija un elemento). En tanto que los elementos metálicos de los grupos IIIB al IIB se identifican como: (elija un elemento).
- Las propiedades: (elija un elemento) son las que dependen de los electrones de valencia y del número atómico.
- La distribución electrónica (D.E.) de los elementos de transición termina en el subnivel: (elija un elemento). La D.E. de los metales alcalinos y alcalinotérreos termina en el subnivel: (elija un elemento). La D.E. de los elementos de los grupos IIIA al VIIIA termina en: (elija un elemento). La D.E. de los elementos «tierras raras» termina en: (elija un elemento).
-
Apareamientos
-
Electrones de valencia y grupos de la tabla periódica
En la columna 1, se indican los ocho grupos de la tabla periódica y en la columna 2 se dan los números de los electrones externos. Coloque en el espacio de la izquierda el número que corresponde a cada grupo:
| COLUMNA 1 |
ELEMENTO |
COLUMNA 2 |
| Subgrupos |
|
Electrones de Valencia |
| IA |
(Elija un elemento) |
0 |
| IIA |
(Elija un elemento) |
1 |
| IIIA |
(Elija un elemento) |
2 |
| IVA |
(Elija un elemento) |
3 |
| VA |
(Elija un elemento) |
4 |
| VIA |
(Elija un elemento) |
5 |
| VIIA |
(Elija un elemento) |
6 |
| VIIIA |
(Elija un elemento) |
7 |
-
Propiedades periódicas y número atómico
Indique en la columna de la izquierda el número que le corresponde a la derecha:
| Columna 1 |
Descripción |
Columna 2 |
Z |
| a. (Elija un elemento) |
Bajo potencial de ionización. |
1 |
Z = 25 |
| b. (Elija un elemento) |
Nivel 4 completamente lleno con electrones. |
2 |
Z = 7 |
| c. (Elija un elemento) |
Halógeno |
3 |
Z = 83 |
| d. (Elija un elemento) |
Átomo con todos sus electrones apareados. |
4 |
Z = 5 |
| e. (Elija un elemento) |
3 electrones en el último subnivel p. |
5 |
Z = 1 |
| f. (Elija un elemento) |
Su configuración electrónica termina en p1. |
6 |
Z = 55 |
| g. (Elija un elemento) |
Subnivel d semilleno. |
7 |
Z = 30 |
| h. (Elija un elemento) |
Radio atómico más pequeño. |
8 |
Z = 53 |
-
Preguntas abiertas
-
Responde las preguntas a partir de la información siguiente:
La Tabla Periódica se encuentra organizada por grupos y periodos, cada uno de ellos con características que hacen que los elementos se ubiquen de manera especial. El grupo VIA y el periodo 3 comprenden un conjunto de elementos algunos con propiedades periódicas semejantes.
- Organice los elementos del grupo y el periodo mencionados, en orden creciente de electronegatividad.
- Indique los electrones de valencia que tiene cada uno de los elementos mencionados en la información.
- ¿Cuántos electrones le falta a cada uno de los elementos del periodo 3 para cumplir con la regla del octeto?
- Según la ley del octeto, los elementos del grupo VIA, ¿a qué gas noble tenderían a parecerse?
-
Argumentar qué información de cada información es correcta o incorrecta:
- El sodio, el potasio y el aluminio, son elementos representativos y a su vez son elementos metálicos alcalinotérreos, porque presentan las características que definen a los elementos metálicos. RESPUESTA /: ...
- Para ubicar un elemento en la tabla periódica, se requiere conocer el número atómico o el número de electrones de un elemento, ya que siempre el número de protones es igual al número de electrones. RESPUESTA /: ...
- Todos los elementos representativos se encuentran completando el subnivel «p» y todos los elementos de transición se encuentran completando el subnivel «d». RESPUESTA /: ...
- El radio atómico, la energía de ionización, la afinidad electrónica y la electronegatividad son propiedades periódicas que aumentan en un grupo de la tabla periódica de arriba hacia abajo y en un periodo aumentan de izquierda a derecha. RESPUESTA /: ...
-
Juego didáctico: Quimitris de Tabla Periódica
A continuación, vamos a realizar un entretenido juego para aprender a ubicar los elementos químicos en la Tabla Periódica. Este juego se llama Quimitris.
Quimitris en juego que se basa en el Tetris. Las fichas, formadas por uno, dos, tres o cuatro elementos químicos, caerán desde la parte superior del tablero y deberás colocarlas de forma correcta en la Tabla Periódica. El juego se encuentra dividido en diferentes niveles y fases que aumentarán su dificultad de forma progresiva.
Para empezar a jugar debes ingresar a la página: http://www.quimitris.com/  y registrarte como usuario. Todas las indicaciones para realizar el juego se encuentran descritas en la misma página. y registrarte como usuario. Todas las indicaciones para realizar el juego se encuentran descritas en la misma página.
El juego comprende 18 (dieciocho) niveles dentro de los cuales se encuentran varias fases.
Para la resolución correcta de estas actividades, debes completar por lo menos los primeros 4 (cuatro) niveles del juego y tomar una captura (imagen) de pantalla (con la tecla: IMPR PANT de tu computador y guardarla en formato .jpg, .png o .jpeg). Luego, debes insertar la imagen de tu puntuación obtenida en el trabajo a entregar.
¡JUEGA, APRENDE Y DIVIÉRTETE!
|
|
|
|
| |
|
|
Actividad No. 2: Enlace Químico
| |
|
|
| |
|
Descripción de la actividad |
-
Preguntas conceptuales
Responde brevemente las siguientes preguntas luego de haber estudiado la Guía 2 Grado Décimo, ubicada en el Menú contexto de la Guía en la Plataforma del curso de Química.
- Define con tus palabras la diferencia que existe entre las teorías sobre formación de enlaces químicos: teoría del enlace de valencia y teoría del orbital molecular.
- Define con tus palabras qué son la «regla del octeto» y qué son los «electrones de valencia».
- ¿Qué parte del átomo interviene en la formación de un enlace químico?
- ¿Cuáles son los tipos de enlaces químicos que hemos estudiado?
- ¿Cómo se forman los enlaces químicos: iónicos, covalentes polares y no-polares?
- Describe las especies químicas que se forman a partir de un enlace iónico: aniones y cationes.
- ¿Cuál es la importancia de la electronegatividad en la caracterización de un enlace químico?
- Resume cuáles son los valores de acuerdo a la diferencia de electronegatividad entre dos átomos, que definen si tenemos un enlace iónico, covalente polar ó covalente no-polar.
- ¿Qué son las Estructuras de Lewis y para qué sirven?
- ¿Qué es un enlace covalente coordinado o dativo? Si definimos su naturaleza en términos de la electronegatividad, ¿podría decirse que es una variación de un enlace iónico o de un enlace covalente?
- Lista por lo menos 10 (diez) compuestos que no cumplen con la Regla del Octeto.
- ¿En qué consiste la polaridad en las moléculas y qué es el momento dipolar?
-
Verdadero o falso
Inferir cuáles de las siguientes proposiciones son Verdaderas (V) o Falsas (F) marcándolas con una X en el paréntesis que aparece al frente. Luego, sustenta tus respuestas:
| Número |
Elemento |
Proposición |
| 1 |
(Elija un elemento) |
Los «electrones de valencia» son aquellos situados en el último «subnivel de energía». |
| 2 |
(Elija un elemento) |
Para que se forme un enlace químico siempre debe existir participación de electrones. |
| 3 |
(Elija un elemento) |
Los compuestos formados entre los elementos del grupo IA con los del VIA son iónicos. |
| 4 |
(Elija un elemento) |
El agua es un compuesto iónico. |
| 5 |
(Elija un elemento) |
Si una molécula presenta enlaces iónicos y enlaces covalentes, se comporta como un compuesto iónico. |
| 6 |
(Elija un elemento) |
El carácter polar de un enlace es independiente de las electronegatividades de los átomos enlazados. |
| 7 |
(Elija un elemento) |
La mejor estructura de Lewis para un compuesto, es la que contenga más enlaces dativos. |
| 8 |
(Elija un elemento) |
Los enlaces iónicos son más polares que los covalentes. |
| 9 |
(Elija un elemento) |
La covalencia de un átomo es igual al número de electrones que le falta para adquirir para adquirir la configuración de un gas noble. |
| 10 |
(Elija un elemento) |
La polaridad de una molécula solo depende de la polaridad de sus enlaces. |
| 11 |
(Elija un elemento) |
En todos los compuestos se cumple la «regla del octeto». |
| 12 |
(Elija un elemento) |
En un enlace covalente no-polar, los átomos atraen de forma desigual el par de electrones compartido. |
| 13 |
(Elija un elemento) |
Las moléculas de los gases nobles son monoatómicas. |
| 14 |
(Elija un elemento) |
El enlace iónico se presenta entre átomos con diferencia de electronegatividades mayor o igual a 1,00 (uno coma cero). |
| 15 |
(Elija un elemento) |
El enlace covalente no-polar se presenta entre átomos con una diferencia de electronegatividad igual a 0,00 (cero coma cero.) |
Sustentación: debes explicar por qué una u otra proposición como Verdadera o Falsa:
| Número |
Sustentación |
| 1 |
R/: sustente su respuesta. |
| 2 |
R/: sustente su respuesta. |
| 3 |
R/: sustente su respuesta. |
| 4 |
R/: sustente su respuesta. |
| 5 |
R/: sustente su respuesta. |
| 6 |
R/: sustente su respuesta. |
| 7 |
R/: sustente su respuesta. |
| 8 |
R/: sustente su respuesta. |
| 9 |
R/: sustente su respuesta. |
| 10 |
R/: sustente su respuesta. |
| 11 |
R/: sustente su respuesta. |
| 12 |
R/: sustente su respuesta. |
| 13 |
R/: sustente su respuesta. |
| 14 |
R/: sustente su respuesta. |
| 15 |
R/: sustente su respuesta. |
-
Completación
Completar los espacios en blanco en las siguientes frases, seleccionando la mejor opción:
- La formación de un enlace iónico se efectúa cuando los átomos que se combinan difieren ampliamente en la: (elija un elemento).
- Si la diferencia de electronegatividad es menor a 1.70 y mayor a 0.00, el enlace es: (elija un elemento). En tanto que, si la diferencia de electronegatividad es igual a 0.00 y se presenta entre átomos de un mismo elemento, decimos que es un enlace: (elija un elemento).
- Cuando ocurre un enlace iónico se transfieren electrones de un átomo a otro durante la formación de dicho enlace, siendo esta propiedad denominada: (elija un elemento).
- Si analizamos la Tabla Periódica y la variación de la electronegatividad a lo largo de la misma, podemos afirmar que el elemento más electronegativo es el: (elija un elemento). Mientras que el elemento menos electronegativo es el: (elija un elemento).
- Decimos que cuando en un enlace el par electrónico es aportado por uno de los átomos y los comparte con el otro átomo con quién forma el enlace, se trata de un enlace: (elija un elemento).
- La mayoría de los compuestos inorgánicos son compuestos: (elija un elemento). En tanto que, la mayoría de los compuestos orgánicos son compuestos: (elija un elemento).
- Especies que presentan igual número de electrones sin importar a qué elemento químico pertenezcan se denominan: (elija un elemento).
- La: (elija un elemento) es el número de electrones que le faltan a un átomo en su estado electrónico natural para cumplir la regla del octeto.
- El oxígeno pertenece al grupo VIA y puede por tanto formar: (elija un elemento). El nitrógeno pertenece al grupo VA y puede formar: (elija un elemento). El carbono pertenece al grupo IV lo cual implica que puede formar: (elija un elemento).
-
Diagrama de flujo
Elabora un diagrama de flujo para resumir los pasos en la selección de estructuras de Lewis correctas (sección 5.3.2. Guía 2 Grado Décimo, pág. 30), considerando las reglas para establecer estructuras de Lewis (sección 5.3.3. Guía 2 Grado Décimo, página 27) y las condiciones para determinar la carga formal sobre un átomo (sección 5.3.3. Guía 2 Grado Décimo, página 31).
Para resolver esta actividad, debes repasar los temas citados y luego consultar sobre los «diagramas de flujo» en internet en los motores de búsqueda señalados en las Fuentes de Aprendizaje. Un ejemplo de diagrama de flujo para la elaboración de un trabajo sobre RRHH (recursos humanos) es como sigue:
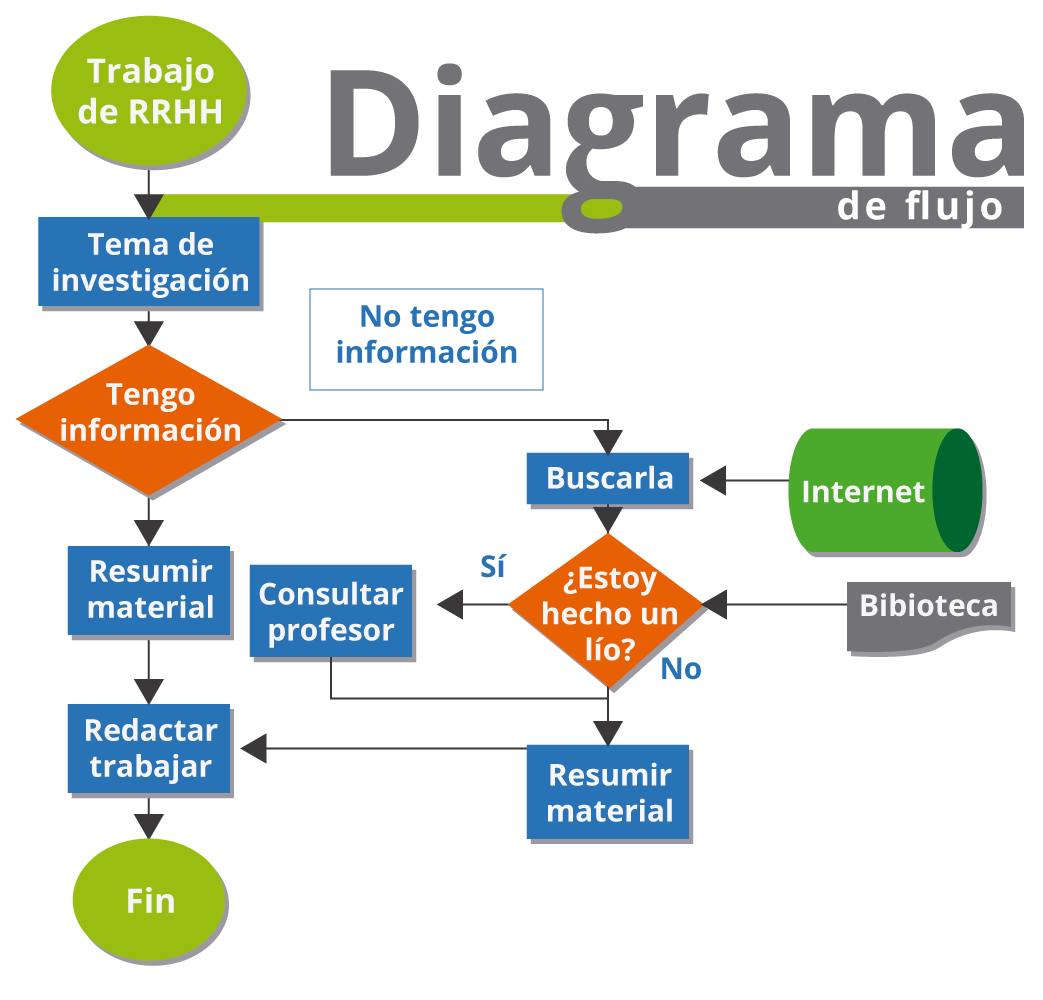
Además, debes emplear los símbolos utilizados para elaborar «diagramas de flujo», tal y como se ilustra en la imagen anterior. Algunas páginas de internet útiles para aprender a elaborar diagramas de flujo son las siguientes:
-
Juego didáctico: Test sobre Enlace Químico
A continuación, resolveremos un segundo juego entretenido para afianzar nuestros conocimientos y saberes sobre el Enlace Químico. Este es también un juego en línea denominado Testeando: Enlace Químico.
Testeando es una herramienta educativa y lúdica pensada para profesores y estudiantes de los colegios españoles y latinoamericanos. Consiste en un juego de preguntas y respuestas tipo test o trivial, agrupadas por cursos y asignaturas que responden al desarrollo curricular del periodo educativo. En cada partida, el juego plantea diez preguntas con cuatro respuestas distintas, de las que sólo una es correcta. Las preguntas acertadas puntúan positivamente en función del tiempo tardado en responder, mientras que las falladas restan puntos al resultado final. Durante el transcurso del juego, el alumno puede hacer uso de hasta tres comodines (50%, 2x1, La clase) para responder a las preguntas. Tras cada partida, el alumno puede volver a jugar al mismo test con las mismas preguntas para repasar conceptos, o jugar con nuevas preguntas sobre el mismo tema.
Para empezar a jugar el Test de Química, referente al Enlace Químico, debes ingresar a la página: http://www.testeando.es/test.asp?idA=43&idT=hzkchkio  Todas las indicaciones para realizar el juego, se encuentran descritas en la misma página. Todas las indicaciones para realizar el juego, se encuentran descritas en la misma página.
Para la resolución correcta de estas actividades, debes alcanzar un porcentaje mínimo del 70% como resultado de una prueba de 10 preguntas y luego tomar una captura de (imagen) en pantalla (con la tecla: IMPR PANT de tu computador y guardarla en formato .jpg o .jpeg). Luego, debes insertar la imagen de tu puntuación obtenida en el trabajo a entregar.
¡JUEGA, APRENDE Y DIVIÉRTETE!
|
|
|
|
| |
|
|
Actividad No. 3: Nomenclatura Química Inorgánica
| |
|
|
| |
|
Descripción de la actividad |
-
Preguntas conceptuales
Responde brevemente las siguientes preguntas, luego de haber estudiado la Guía 2 Grado Décimo, ubicada en el Menú contexto de la Guía en la plataforma del curso de Química.
- Define con tus palabras qué es el estado o número de oxidación para un átomo de un elemento y qué aspectos se tienen en cuenta para su determinación.
- Define los siguientes conceptos:
- ¿Qué es la nomenclatura química?
- ¿Qué es una función química?
- ¿Qué es un grupo funcional?
- ¿Cómo se clasifican las funciones químicas en: compuestos binarios, compuestos ternarios y compuestos cuaternarios?
- ¿Qué se entiende por: óxido básico, óxido ácido, hidrácido, sal haloide, peróxido, superóxido e hidruro metálico?
- ¿Qué se entiende por: hidróxido, oxácido, oxisal, sal doble y sal ácida?
- ¿En qué consisten los sistemas de nomenclatura en química inorgánica: nomenclatura tradicional, nomenclatura sistemática y nomenclatura Stock-Werner?
- ¿Qué ion es responsable de las propiedades ácidas de las soluciones acuosas de los ácidos? Y ¿qué ion es responsable de las propiedades básicas de las soluciones acuosas de las bases?
-
Completación
- La nomenclatura química surgió por la necesidad de establecer reglas para los compuestos químicos considerando que antiguamente se daban nombres: (elija un elemento).
- Al conjunto de propiedades comunes que caracterizan a una serie de sustancias, y por las cuáles se diferencian de las demás, se denomina: (elija un elemento).
- El átomo o grupo de átomos cuya presencia en la molécula determina sus propiedades características se denomina: (elija un elemento).
- La carga que posee un átomo de un elemento cuando se encuentra combinado con otro(s) elemento(s) se define como: (elija un elemento).
- Los: (elija un elemento), cuando se combinan con el oxígeno forman óxidos básicos. En tanto que, los: (elija un elemento), cuando se combinan con el oxígeno forman óxidos ácidos.
- En la mayoría de los compuestos que forma el oxígeno, éste presenta un número de oxidación de: (elija un elemento); mientras que el hidrógeno presenta, en la mayoría de los compuestos que forma, un número de oxidación de: (elija un elemento).
- Los elementos que más variación presentan en su número de oxidación en la tabla periódica, puede decirse que son los elementos: (elija un elemento).
- Para determinar el número de oxidación de un átomo de un elemento en un compuesto, podemos hacerlo de forma cuantitativa conociendo los valores de los números de oxidación de otros átomos, planteando una: (elija un elemento) de tipo algebraica.
- Cuando un elemento no-metálico se combina con el oxígeno se obtiene un: (elija un elemento). En tanto que, cuando un elemento metálico se combina con el oxígeno se obtiene un: (elija un elemento).
- La combinación de un no-metal con el hidrógeno genera un: (elija un elemento). Mientras que la combinación de un metal con el hidrógeno origina un: (elija un elemento).
-
Verdadero o falso
Inferir cuáles de las siguientes proposiciones son Verdaderas (V) o Falsas (F) marcándolas con una X en el paréntesis que aparece al frente. Luego, sustenta tus respuestas:
| Número |
Elemento |
Proposición |
| 1 |
(Elija un elemento) |
Toda sustancia que cede electrones se puede decir que es electropositiva. |
| 2 |
(Elija un elemento) |
En los hidruros, el hidrógeno presenta estado de oxidación positivo. |
| 3 |
(Elija un elemento) |
La sal de cocina es una oxisal. |
| 4 |
(Elija un elemento) |
Una sal puede formarse por la reacción entre un óxido y un ácido. |
| 5 |
(Elija un elemento) |
Una sal puede formarse por la reacción entre un hidróxido y un ácido. |
| 6 |
(Elija un elemento) |
El estado de oxidación del oxígeno siempre es « -2 ». |
| 7 |
(Elija un elemento) |
El estado de oxidación del hidrógeno no siempre es « +1 ». |
| 8 |
(Elija un elemento) |
Pueden existir no-metales conductores de la corriente eléctrica. |
| 9 |
(Elija un elemento) |
Los metales siempre tienen número de oxidación positivo. |
| 10 |
(Elija un elemento) |
El estado de oxidación solo depende del número de electrones del último nivel de energía. |
Sustentación: debes explicar por qué una u otra proposición como Verdadera o Falsa:
| Número |
Sustentación |
| 1 |
R/: sustente su respuesta. |
| 2 |
R/: sustente su respuesta. |
| 3 |
R/: sustente su respuesta. |
| 4 |
R/: sustente su respuesta. |
| 5 |
R/: sustente su respuesta. |
| 6 |
R/: sustente su respuesta. |
| 7 |
R/: sustente su respuesta. |
| 8 |
R/: sustente su respuesta. |
| 9 |
R/: sustente su respuesta. |
| 10 |
R/: sustente su respuesta. |
-
Juego didáctico: Test sobre Nomenclatura Química Inorgánica
Para afianzar nuestros conocimientos y saberes sobre la Nomenclatura en Química Inorgánica, vamos a realizar un tercer juego en línea. Este juego en línea es un Test (cuestionario) que trata sobre «los números de oxidación y las fórmulas químicas». Las preguntas son conceptuales y de análisis, así que ten mucho cuidado al responder. Este es el Test No. 2 de la plataforma educativa: La manzana de Newton.

Para empezar a jugar el Test de Química, debes ingresar a la página:
http://www.lamanzanadenewton.com/materiales/aplicaciones/lfq/lfq_cuestionario02.html  . .
Todas las indicaciones para realizar el juego se encuentran descritas en la misma página.
Para la resolución correcta de estas actividades, debes lograr responder correctamente mínimo 7 preguntas de una prueba de 10 preguntas y luego tomar una captura de (imagen) en pantalla (con la tecla: IMPR PANT de tu computador y guardarla en formato .jpg o .jpeg). Luego, debes insertar la imagen de tu puntuación obtenida en el trabajo a entregar.
¡JUEGA, APRENDE Y DIVIÉRTETE!
|
|
|
|
| |
|
|
Fuentes de aprendizaje
| |
|
|
| |
|
Fuentes de aprendizaje |
|
Como Fuentes de Aprendizaje en ambientes educativos virtuales, tal y como se define en la metodología de enseñanza-aprendizaje en el I.E. Cibercolegio U.C.N., se permiten las siguientes modalidades para las consultas de información, que se aplican también en la modalidad de estudio presencial y que en la modalidad de estudio virtual se amplían y enriquecen, siempre que se respeten las normas de autor y se citen las fuentes de consulta de forma correcta de acuerdo con las Normas APA v. 8 o la Norma ICONTEC NTC 1486.
Fuentes de aprendizaje virtual: para los estudiantes del Cibercolegio:
- Materiales didácticos, como interactivos, tutoriales, sitios Web o libros electrónicos, entre otras. Es probable que esta información sea más susceptible a ser modificada y actualizada que los medios impresos. En internet, hacemos uso de «buscadores» y «metabuscadores» para consultar información. Además, existen sitios de internet donde se pueden subir y compartir videos educativos.
- Buscadores: Son programas o aplicaciones que al ingresar una palabra en el recuadro nos brindan toda la información recopilada en diferentes páginas anexas. Los buscadores más usados son: Google.com, Yahoo.com; otros buscadores son: Ask.com, Altavista.com, Noxtrum.com, Overture.com, Terra.com y AOL.com, entre otros.
- Metabuscadores: Son servicios que lanzan a internet sus robots (un software) que ordenan y clasifica las páginas que encuentran en internet sirviéndose de criterios objetivos que deberan hallar en el código HTML de esas páginas, los títulos y textos de las mismas. Los metabuscadores no disponen de una base de datos propia que mantener sino que utilizan las de varios buscadores para encontrar la información solicitada por el usuario. Después muestra una combinación de las mejores páginas que ha devuelto cada buscador. Algunos de los metabuscadores más conocidos son: Lomejor.com, Vivisimo.com, Copernic.com, Ixquick.com, Metacrawler.com, Albany.net, Dogpile.com, entre otros.
- Sitios para subir, ver y compartir videos: Se puede decir que el más popular es Youtube.com, sin embargo, existen otros sitios como: Vimeo.com y DailyMotion.com, entre otros.
- Comunicación e interacción a través de herramientas de internet: el correo electrónico, videoconferencias o llamadas (Skype), enlaces asincrónicos, grupos de discusión (Foros de Plataforma), entre otros, para consultas con el Facilitador o grupos de estudio. Si la modalidad es «asincrónica», la comunicación es predominantemente escrita, a diferencia de la modalidad «sincrónica» en la cual la comunicación oral es predominante.
- Contexto natural, sería enriquecido a través de los sistemas de realidad virtual, simuladores o video entre otros. Con este recurso, los estudiantes pueden realizar un número ilimitado de observaciones o pruebas, mientras que en la modalidad presencial, estas posibilidades son más reducidas.
Como ejemplos de recursos educativos de acuerdo con las Fuentes de Aprendizaje descritas, para complementar y ampliar el estudio de las presentes actividades de la Guía 2 Nivel 1, además la Guía 2 de Aprendizaje y los recursos educativos dispuestos en Plataforma para Grado Décimo, tenemos los siguientes páginas de internet:
|
|
|
|
| |
|
|
|
|
|
| |
|
| |
| |
| |
|
|
| |
Descargar  Formato word Formato word
Actividades nivel 1 |
|
|
| |
|
|
|
|
|
|