1. Relaciona los diferentes tipos de enlaces químicos.
2. Comprende el método de balanceo de ecuaciones.
3. Conceptualiza el significado de las formulas químicas.
4. Comprende la nomenclatura química.
5. Identifica ácidos, bases, sales y óxidos.
- Guía de actividades
- Actividad 1
- Actividad 2
- Actividad 3
- Actividad 4
- Fuentes de aprendizaje
 Guía de actividades Guía de actividades
Indicaciones: Debes desarrollar las siguientes actividades correspondientes al desempeño , enviarla en un solo archivo en Word a través de la opción correspondiente en la herramienta tareas, es importante que antes de desarrollarlas visites las fuentes de aprendizaje recomendadas al final de las actividades.
Actividad
| |
|
|
| |
|
Descripción de la Actividad 1 |
Enlace químico y formas de las moléculas

1. Enlace químico, fuerza entre los átomos que los mantiene unidos en las moléculas. Cuando dos o más átomos se acercan lo suficiente, puede producirse una fuerza de atracción entre los electrones de los átomos individuales y el núcleo de otro u otros átomos. Si esta fuerza es lo suficientemente grande para mantener unidos los átomos, se dice que se ha formado un enlace químico. Todos los enlaces químicos resultan de la atracción simultánea de uno o más electrones por más de un núcleo.
Tipo de enlace |
Ejemplo |
Grafica |
Tipo de estructura |
Ejemplo de la estructura |
Propiedades características |
Enlace iónico |
|
|
|
|
|
Enlace covalente |
|
|
|
|
|
Enlace metálico |
|
|
|
|
|
Enlaces múltiples |
|
|
|
|
|
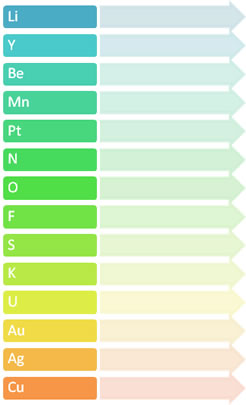
2. La electronegatividad, (abreviación EN, símbolo χ (letra griega chi)) es una propiedad química que mide la capacidad de un átomo (o de manera menos frecuente un grupo funcional) para atraer hacia él los electrones, o densidad electrónica, cuando forma un enlace covalente en una molécula. También debemos considerar la distribución de densidad electrónica alrededor de un átomo determinado frente a otros, tanto en una especie molecular como en un compuesto no molecular. La electronegatividad de un átomo determinado está afectada fundamentalmente por dos magnitudes, su masa atómica y la distancia promedio de los electrones de valencia con respecto al núcleo atómico.
Establece la electronegatividad de los siguientes elementos:
|
|
|
|
| |
|
|
Actividad No. 2
| |
|
|
| |
|
Descripción de la Actividad 2 |
La nomenclatura química
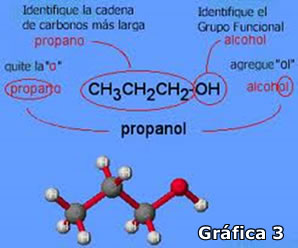
La química tiene su propio lenguaje, a lo largo de su desarrollo se han descubierto miles y miles de compuestos y con ellos un gran número de nombres que los identifican. En la actualidad el número de compuestos sobrepasa los 13 millones, en respuesta a esto, a lo largo de los años los químicos han diseñado un sistema aceptado mundialmente para nombrar las sustancias químicas lo que ha facilitado el trabajo con la variedad de sustancias que existen y se descubren constantemente.
La primera distinción básica en la nomenclatura química, es entre los compuestos orgánicos e inorgánicos donde el primer término se refiere a la mayoría de aquellos compuestos que contienen el elemento carbono. A continuación se expondrá gran parte de la nomenclatura básica para los compuestos inorgánicos. Estos compuestos se pueden dividir por conveniencia en cuatro clases o funciones; oxido, base, ácido y sal.
1. Nomenclatura clásica:
En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos.
Característica |
Sufijo o prefijo |
Ejemplo |
Nombre |
Cuando el elemento sólo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba |
“de” |
Na2O |
oxido de sodio |
Cuando tiene dos valencias diferentes se usan los sufijos |
|
|
|
Cuando tiene tres distintas valencias se usan los prefijos y sufijos |
|
|
|
Cuando tiene cuatro distintas valencias se usan los prefijos y sufijos |
|
|
|
2. Nomenclatura sistemática.
Se llama también Nomenclatura iupac, para esta nomenclatura se tiene en cuenta el número de átomos presentes de cada elemento y para ello se usan prefijos numéricos excepto para indicar que el primer elemento de la fórmula sólo aparece una vez (mono) o cuando no puede haber confusión posible debido a que tenga una única valencia.
|
Definición |
Se nombran con |
Ejemplos |
Óxidos |
|
|
|
Ácidos |
|
|
|
Bases |
|
|
|
Sales |
|
|
|
3. Nomenclatura Stock.
Esta nomenclatura tiene en cuenta los valores de los estados de oxidación positivos (es decir sólo de los elementos metálicos), los cuales se expresan en la Función Química correspondiente en numeración romana encerrada entre paréntesis, (a menos que la expresión matemática de la fórmula se haya simplificado es posible determinar el valor de oxidación por el número subíndice de la derecha).
|
Como se nombran |
Ejemplos |
Compuestos binarios de metales con no metal |
|
|
Compuestos ternarios |
|
|
|
|
|
|
| |
|
|
Actividad No. 3
| |
|
|
| |
|
Descripción de la Actividad 3 |
Composición de las sustancias –Estequiometria

La estequiometría se refiere a las cantidades de reaccionantes y productos comprendidos en las reacciones químicas. Para una reacción hipotética;
Surgen preguntas como estas ¿Cuanto se necesita de A para que reaccione con x gramos de B? ¿Cuanto se producirá de C en la reacción de A con x gramos de B? ¿Cuanto se producirá de B junto con Y gramos de C?. Las cantidades químicas es decir, el "cuanto" de las preguntas anteriores se pueden medir de diferentes maneras. Los sólidos generalmente se miden en gramos, los líquidos en mililitros y los gases en litros. Todas estas unidades de cantidad se pueden expresar también en otra unidad, el "mol".
Defina los siguientes conceptos y da sus ecuaciones:
- 1. Defina que es una formula química.
- 2. ¿Qué se entiende por peso molecular? De ejemplos.
- 3. ¿Qué se entiende por mol o moles?
- 4. ¿Cómo se halla el peso total de un compuesto? Da ejemplos.
- 5. ¿Cómo se halla el peso formula?
- 6. ¿Cómo se halla la composición de una sustancia en porcentaje? Da ejemplos.
- 7. ¿Cómo se hallan los gramos de una reacción? Da ejemplos.
- 8. ¿Cómo se halla las moles de átomo de un elemento? Da ejemplos.
- 9. ¿Cómo determinamos la fórmula molecular? Da ejemplos
- 10. ¿Cómo determinamos la formula estructural? Da ejemplos
|
|
|
|
| |
|
|
Actividad No. 4
| |
|
|
| |
|
Descripción de la Actividad 4 |
Las ecuaciones y las reacciones químicas

Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (reactivos ó reactantes) y las sustancias o productos que se obtienen. También nos indican las cantidades relativas de las sustancias que intervienen en la reacción. Las ecuaciones químicas son el modo de representarlas.
Se utilizan para describir lo que sucede en una reacción química en sus estados inicial y final. En ella figuran dos miembros; en el primero, los símbolos o fórmulas de los reactantes, reaccionantes o reactivos y en el segundo los símbolos o fórmulas de los productos. Para separar ambos miembros se utiliza una flecha que generalmente se dirige hacia la derecha, indicando el sentido de la reacción.
1. Explique de forma clara los siguientes puntos, ten presente dar ejemplos donde se pueda apreciar los pasos utilizados.
|
Método para escribir ecuaciones |
Método del tanteo |
Método del número de oxidaciones. |
Balanceo de ecuaciones de oxidación-reducción. |
2. Explique los diferentes tipos de reacciones químicas.
- a. Reacciones de composición.
- b. Reacciones de descomposición.
- c. Reacciones de reemplazamientos
- d. Reacciones de iones.
|
|
|
|
| |
|
|
|
|